研究
私たちの研究室では、主に遺伝子ノックアウトマウスや培養細胞を用いた解析を通し、心不全をはじめとした心疾患のメカニズムを明らかにしようとしている。未知の生命現象を解明することを通じて、疾患に対する新たな治療方法を創出していきたいと考えている。現在では、以下のテーマに焦点をあてて研究を行っている。
(1)Gタンパク質共役型受容体(GPCR)に関する研究
受容体とは、細胞外からの刺激を感知することで、細胞内にその情報を伝える重要な分子である。GPCRは、受容体の中でも大きなファミリーを構成する分子群であり、これまでにGPCRをコードする遺伝子は1,000以上報告されてきた。さらに、GPCRは細胞表面に存在しているため、創薬のターゲットとしても非常に注目されている。実際、世の中に市販されている治療薬の約3割がGPCRをターゲットにしたものである。
これまで、私たちの研究室では、βアドレナリン受容体に関連したシグナル伝達に関する研究を行ってきた。
最近では、これまでβアドレナリン受容体からのシグナル伝達を遮断するだけだと考えられてきた、βブロッカーの一つであるメトプロロールが、βアドレナリン受容体は介するが、Gタンパク質非依存的にGRK5とβ-アレスチン2を介して心臓の線維化シグナルを誘導しうることを明らかにした(Nakaya M, et al. J Biol Chem, 2012)。
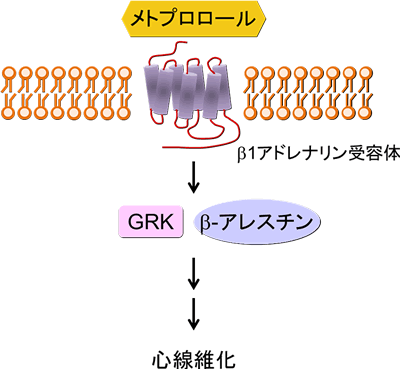
現在、私たちはβアドレナリン受容体以外のいくつかのGPCRが心臓の病態形成に関わる可能性について、それら受容体のノックアウトマウスを用いて検討を行っている。
(2)Gタンパク質共役型受容体キナーゼ(GRK)およびβ-アレスチンに関する研究
私たちは、GPCRに関する研究のみならず、GPCRの機能を制御する分子として長年知られてきた、GRKとβ-アレスチンに着目した研究を行っている。
GRKはリガンドが結合して活性化したGPCRをリン酸化する酵素として同定されたキナーゼである。一方で、β-アレスチンはGRKによってリン酸化されたGPCRに結合し、GPCRの脱感作に関与する作用を持つ。近年、GRKやβ-アレスチンが、GPCRの活性を制御する以外の機能を持つ事が明らかにされつつあるが、それら機能については依然として不明な点が多い。
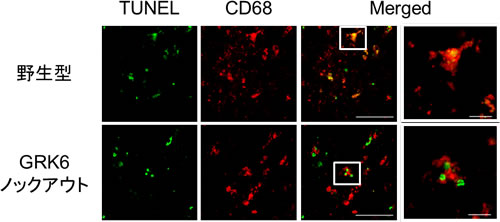
私たちはGRKのサブタイプの1つであるGRK6が、マクロファージによるアポトーシス細胞の貪食を促進する分子であることを見出した。実際、遺伝的にGRK6を欠損したノックアウトマウスにおいては、脾臓においてアポトーシス細胞が適切に処理されずに残存し、その結果、死細胞から内容物が流出してしまい、自己免疫疾患の一つである、全身性エリトマトーデス様の症状を呈することを見出した(Nakaya M, et al. Nat Commun, 2013)。
また、β-アレスチン2が、心筋梗塞時において梗塞部位へ浸潤してくるマクロファージに多く発現しており、心筋梗塞時において炎症応答を制御する重要な分子であることを発見した(Watari K, et al. PLOS ONE, 2013)。
私たちは現在も、GRKやβ-アレスチンの上記現象以外の生理的意義を明らかにするため、様々な臓器・疾患に着目して研究を行っている。
(3)心不全時における心線維化のメカニズム解析
心不全は心臓がポンプとしての機能を十分に果たせなくなった状態(全身に十分な血液を送れなくなった状態)で、さまざまな循環器疾患の最終像としてとらえられており、心不全と診断された後の5年生存率は約50%と低い。心不全は心臓に圧負荷がかかった場合に加え、心筋梗塞により心臓が働くための酸素供給が低下・停止された場合にも生じる。心不全は心肥大を経て進行するため、心肥大のメカニズムを解明することで、新たな心不全治療薬を見つけることができるのではと考えられている。
私たちの研究室では、心不全時に観察される線維化について焦点を当てて解析している。
線維化とは、細胞外にコラーゲンが過剰に蓄積してくる現象で、心臓が硬くなり収縮・弛緩サイクルのうち、とくに弛緩(拡張)機能が損なわれる。線維化の原因となるコラーゲンの産生は、生体内では筋線維芽細胞によって行われている。
薬物治療を考えると、過剰な線維化を抑制するためには、筋線維芽細胞の活性を抑制する必要がある。そこで、筋線維芽細胞の活性調節に重要な機能を担っている分子を生化学的あるいは分子生物学的手法の適用などにより探索し、それら分子をノックアウトあるいは過剰発現させたマウスを用いてそれぞれの分子の機能を個体レベルで検証していこうと考えている。
さらに、薬物治療につながるリード化合物を見つけるため、共同研究により線維化を制御する受容体の拮抗薬(作用を阻害する)あるいは作動薬(作用を引き起こす)を開発することも行っている。
線維化は心臓のみならず肺や肝臓でも生じる現象で、また薬剤などによっても引き起こされる。心臓で確立した線維化モデルが肺や肝臓にも適用できるのか、線維化を制御する分子の活性を阻害することにより生じた機能障害を回復させることができるのかなどについても研究を行っていきたいと考えている。

